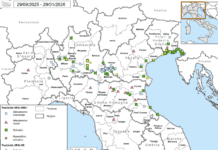
L’ultimo convegno mondiale di patologia aviare ha avuto un protagonista assoluto: l’Influenza Aviaria. Su questo tema, estremamente attuale, ha fatto il punto la dott.ssa Isabella Monne dell’Istituto Zooprofilattico Sperimentale delle Venezie, presentando alcuni significativi esempi volti a comprendere meglio questo patogeno che tanto preoccupa il comparto avicolo.
Uno degli aspetti più preoccupanti del virus dell’Influenza Aviaria è la sua grande capacità di mutare, generando un’infinita serie di nuovi ceppi, grazie alla propria costituzione genetica poco stabile. Tali mutazioni possono essere sia progressive che improvvise. Negli ultimi anni abbiamo assistito alla nascita di diversi nuovi ceppi, emersi nel settore avicolo. Proprio a causa delle modificazioni del virus HPAI (Gs/GD-H5Nx), la comunità scientifica sta assistendo a una sostanziale modificazione dei concetti basilari che finora avevano costituito le conoscenze base sull’Influenza Aviaria.
Alcune delle nozioni classiche, date ormai per scontate, erano:
- gli avicoli selvatici sono i portatori naturali dell’Influenza;
- i virus provenienti da Americhe o Eurasia appartengono a cladi diversi, indipendentemente dai sierotipi;
- i ceppi LPAI hanno lenta diffusione nei gruppi colpiti e possono essere asintomatici, mentre quelli HPAI si diffondono rapidamente e hanno una sintomatologia conclamata;
- il virus presenta una stagionalità, colpendo prevalentemente in inverno;
- raramente si assiste a una trasmissione nei mammiferi.
Oggi invece viviamo in un mondo di costanti scambi, che facilitano la diffusione virale tra avicoli selvatici e domestici, ampliando notevolmente il range di soggetti colpiti. Il virus stesso è diverso: ad esempio H5N1 2.3.4b ha mostrato riassortimenti in segmenti considerati in precedenza stabili. Negli ultimi due decenni sono morti circa 500 milioni di soggetti e il virus oramai ha diffusione globale. Proprio tale aspetto “globale” è sottolineato dal fatto che non si vedono più differenze tra ceppi di diversi continenti.
L’epicentro di tale diffusione sembra essere il Mediterraneo, dove attraverso le migrazioni stagionali si sono mescolati selvatici portatori di virus diversi, portando allo scambio virale tra Eurasia e Africa. Tale diffusione, inoltre, favorisce l’incontro con altri virus influenzali: ad esempio si sono rilevati geni di H9N2 in H5N1.
Nel 2023 abbiamo assistito in tacchini infettati con 2.3.4.4b H5N1 a una lenta progressione della malattia in allevamento, con bassa mortalità e bassa prevalenza dell’infezione, tanto che i primi casi non derivavano da segnalazioni cliniche, bensì da controlli pre-carico o routinari in zone ad alto rischio. Anche nei polli è stata osservata una progressione lenta della mortalità, diversamente dalla rapida diffusione tipica di HPAI.
Oggi casi di HPAI si rilevano in tutte le stagioni: il virus si propaga anche in estate, fatto preoccupante e in precedenza mai accaduto.
Sono inoltre aumentati i casi di trasmissione ai mammiferi. Al contrario delle nozioni classiche, abbiamo visto H5N1 infettare gravemente mammiferi da pelliccia in Spagna e Finlandia, migliaia di leoni di mare in Perù, Cile e Argentina, foche in USA e addirittura gatti in Polonia. I virus isolati dai mammiferi paiono avere mutazioni che ne aumentano notevolmente il potenziale zoonotico. Si ipotizza che una delle fonti di contaminazione per i mammiferi derivi dall’ingestione di carne avicola cruda contaminata dal virus, ma c’è anche chi ipotizza la strada inversa: da mammifero ad avicolo (dunque da spill over a spill back). Ci aspettiamo pertanto che altre nuove specie diventino portatrici del virus dell’Influenza Aviaria. Ciò significa che il virus ha acquisito una notevole capacità di mutare in senso zoonotico, a differenza del passato.
È interessante anche notare come siano state osservate delle similitudini comportamentali tra il virus HPAI e il Covid. La ricerca sul Covid-19, infatti, ha favorito anche quella sull’influenza, migliorando la tecnologia molecolare, che consente di caratterizzare il virus e definirne l’evoluzione. Le informazioni, inoltre, come ha sottolineato la dott.ssa Monne, sono oggi facilmente disponibili per la comunità scientifica e questo favorisce lo sviluppo della ricerca. Purtroppo le differenze sociali, culturali, politiche ed economiche dei vari Paesi non consentono un approccio comune nel contrastare la malattia. Certamente il rischio prevalente si verifica nelle zone in cui le popolazioni di soggetti suscettibili sono maggiori: proprio lì si sviluppano nuovi e pericolosi ceppi.
Bisogna quindi modificare o ricostruire gli allevamenti attuali, in modo da implementare le misure di biosicurezza, diminuendo la densità territoriale, evitando di allevare nei pressi di aree umide (in cui è maggiore il rischio di contatto con i selvatici) e controllando le movimentazioni degli avicoli commerciali da e per gli allevamenti, i macelli, gli incubatoi, etc. Sappiamo che il virus che circola difficilmente si autoestinguerà, ma facilmente modificherà, richiedendo maggiori sforzi nella ricerca, tesa a scoprire vaccini sempre nuovi e adeguati a contrastare i nuovi ceppi.
Non dimentichiamo infine l’importanza della sorveglianza, per rilevare in fretta eventuali nuovi ceppi patogeni, riportandoli nel sistema di allerta rapida. La necessità di una efficace sorveglianza, inoltre, è sottolineata anche dalle potenzialità zoonotiche del virus, motivo per cui è essenziale coinvolgere non solo di tutti gli operatori della filiera produttiva, ma anche altre figure della sanità pubblica. La sorveglianza, in precedenza volta prevalentemente agli allevamenti commerciali, dovrà dunque rivolgersi sempre più sia al mondo dei selvatici che a quello dei mammiferi, proprio per la maggiore diffusione osservata rispetto al passato.
La sorveglianza routinaria pre-carico, che controlla le movimentazioni, viene eseguita sia su base clinica, che sierologica e PCR. Ma adesso è diventato necessario fare attenzione anche a diversi altri aspetti, aumentando il campionamento ai macelli, eseguendo piani di sorveglianza ambientale periodici, adeguando i piani anche a eventuali situazioni nelle quali si utilizza la vaccinazione verso l’AI, e raccogliendo, infine, i soggetti morti dagli allevamenti su base almeno settimanale, per campionamenti in pool.
In caso di emergenza, sarà necessaria, come sopra menzionato, una riduzione del numero di aziende a rischio in zone ad alta densità, anticipando, se del caso, l’età di macellazione, al fine di svuotarle il prima possibile, limitando la diffusione virale.