
In questo articolo, presentato alla XXII World Veterinary Poultry Association Conference che si è tenuta a Verona lo scorso settembre, l’autrice parla del virus della malattia di Marek, valutando le due sindromi che hanno maggiore rilevanza economica nel campo: l’immunosoppressione indotta da MDV (MDV-IS) e i tumori indotti da MDV (MD).
Evoluzione della MD ed MDV
La malattia di Marek (MD) è stata descritta per la prima volta nel 1907 da Joseph Marek. Inizialmente è stata descritta come una polineurite che colpiva solo i soggetti anziani e senza importanza economica. Solo verso la fine degli anni ’50 è stata identificata come un importante rischio per l’industria avicola. La MD non era più solamente una malattia infiammatoria, ma aveva assunto anche forme neoplastiche, colpiva soggetti molto giovani e la mortalità era molto alta. Da allora il suo controllo è diventato fondamentale per lo sviluppo dell’avicoltura. I primi vaccini furono preparati tra la fine degli anni ’60 e gli inizi degli anni ’70 e furono non solo un successo per la produzione, ma anche per la ricerca: si trattava infatti dei primi vaccini efficaci verso i tumori. Tali vaccini però controllavano solo lo sviluppo della malattia, non la sua infezione o trasmissione, e questa mancanza di “sterilizzazione immunitaria” costituisce proprio uno dei principali fattori di aumento di virulenza del virus della malattia di Marek (MDV).
L’MDV è un alfa-herpesvirus del genere Mardivirus che include tre specie: Gallid alphaherpesvirus 2 (precedentemente noto come sierotipo 1 MDV o MDV-1), Gallid alphaherpesvirus 3 (noto come 2 MDV o MDV-2) e Meleagrid herpesvirus (noto come sierotipo 3 or HVT).
MDV-1 include tutti i ceppi oncogenici MDV e le loro forme attenuate. Ne esistono vari patotipi, classificati sulla base della loro capacità di superare le difese costituite dalla vaccinazione. Avremo quindi i ceppi medi (m), virulenti (v), molto virulenti (vv) e molto virulenti più (vv+). Il passaggio da m a v fu osservato verso la fine degli anni ’50; quello da v a vv verso la fine degli anni ’80 in seguito a episodi in gruppi vaccinati con HVT, e infine il passaggio a vv+ causò focolai in gruppi vaccinati HVT+SB-1 e CVI988 verso la fine degli anni ’90.
Oltre a provocare tumori in polli vaccinati, MDV-1 vv+ ha sviluppato altre forme capaci di causare diverse sindromi, tra cui paralisi acuta transitoria, sindromi linfodegenerative, panoftalmite, aterosclerosi e grave immunosoppressione. In questo articolo vedremo le due forme che hanno maggiore rilevanza economica in campo: la immunosoppressione (MDV-IS) e i tumori (MD).
MDV-IS
Si tratta di un sindrome assai complessa, che può venire suddivisa in 3 fasi differenti, che possono non essere correlate tra loro, ma in certi casi invece si sommano. Si tratta delle infezioni citolitiche precoci, che avvengono a carico degli organi linfoidi già pochi giorni dopo l’infezione (MDV-IS precoce), della riattivazione virale dopo un periodo di latenza (MDV-IS/R tardiva) e dello sviluppo dei tumori (MDV-IS/T finale). In ognuna di queste fasi il virus riesce a dare immunosoppressione tramite diversi meccanismi.
MDV-IS precoce
Dopo che il pulcino viene infettato per via respiratoria, il virus viene trasportato verso gli organi linfatici, probabilmente da cellule dendritiche e macrofagi. Nei pulcini sprovvisti di anticorpi materni il virus si trova nella borsa, nella milza e nel timo già a 3 giorni e il picco della sua replicazione avviene tra i 4-6 giorni. Dopo il virus entra in un periodo di latenza e diventa difficile da rilevare. Nel corso della sua replicazione massiva negli organi linfatici, avviene una distruzione dei linfociti per apoptosi e quindi l’organo linfatico si atrofizza. Inoltre, i linfociti che sopravvivono sono alterati e non riescono a proliferare per la presenza di macrofagi soppressori: pertanto si crea una grave immunosoppressione umorale e cellulare. Gli anticorpi materni proteggono in qualche modo il danno iniziale agli organi linfoidi, ma tale effetto è parziale, quando il virus infettante è vv, e soprattutto quando è vv+. La MD precoce è inoltre difficile da diagnosticare in campo, perché l’atrofia degli organi linfoidi può essere causata anche da altri agenti (IBD, CAA, micotossine, etc.). Comunque MDV dovrebbe essere sempre considerata in sede di diagnosi differenziale, specialmente in gruppi non vaccinati.
MDV-IS/R tardiva
Si verifica nel corso della seconda infezione citolitica (3-4 settimane) quando il virus si riattiva dal periodo di latenza. Oltre alla distruzione delle cellule, il virus causa una forte disregolazione delle risposte immunitarie. Questa è la fase più difficile da studiare, perché non è correlata all’atrofia degli organi linfoidi e nemmeno ai tumori. In un modello di studio in laboratorio, che sfrutta la capacità di MDV di mettere a rischio la protezione conferita dai vaccini verso la laringotracheite (ILT), è stato possibile dimostrare che vv+, ma non altri patotipi, è stata capace di bloccare i vaccini CEO nella protezione verso ILT. Inoltre nessuno dei vaccini tradizionali (CVI988; HVT+CVI988; HVT+SB-1 ed SB1 da solo) somministrati in ovo oppure alla schiusa, come pure in protocolli di rivaccinazione, sono stati in grado di proteggere completamente verso la MDV-IS/R causata da ceppi vv+, anche se alcuni protocolli vaccinali proteggevano abbastanza bene verso le forme tumorali. Poiché non disponiamo di metodi di diagnosi o controllo, questa rappresenta una delle peggiori forme di MD al momento.
MDV-IS/T finale
Si verifica una volta che i tumori si sono sviluppati. Poiché essi richiedono una riattivazione virale, l’infezione citolitica secondaria (e la MDV-IS tardiva) possono oltrepassare lo sviluppo tumorale. Le cellule CD4+ T sono quelle più modificate del virus. I tumori possono causare immunosoppressione tramite diversi meccanismi. Le cellule MDV trasformate possono adottare il fenotipo delle cellule T regolatorie e produrre fattori di crescita della citochina beta (TGF-), che può inibire la proliferazione di cellule T e interferire sulla loro funzione. Le cellule trasformate da MDV sopprimono anche la linfoproliferazione e riducono la regolazione di CD28, che è una importante molecola citostimolatrice nell’attivazione delle cellule T. Inoltre, MHC-I viene soppressa nelle cellule tumorali MD a seguito della riattivazione virale e PD-L1 e PD-L2 vengono espressi nei linfomi MD indotti. La rilevazione dei tumori indotti da MDV è sufficiente per confermare la MDV-IS tardiva. Nello stesso modo la protezione nei confronti del tumori indotti garantirà la protezione contro la MDV-IS.
Conseguenze in campo
La capacità di immunosoppressione di MDV e il modo in cui viene controllata dipendono notevolmente dal patotipo e dall’età dei polli alla fine del ciclo. Negli allevamenti di broiler infettati da MDV, anche se non sono vaccinati, potrebbe non verificarsi mai MDV-IS. Se c’è una infezione da ceppi vv+ ma i pulcini sono ben vaccinati verso i tumori indotti da MDV, MDV-IS non si verifica. Però, anche nel caso siano ben protetti nei riguardi delle forme tumorali, soffrono comunque di MDV-IS tardiva nel caso l’infezione sia da vv+. I diversi scenari sono descritti nella Tabella 1.

Studi futuri
Sarà fondamentale capire il meccanismo tramite il quale vv+MDV può indurre immunosoppressione nel pollo, che altrimenti sarebbe protetto nei confronti dei tumori indotti da MDV. La valutazione di come rMd5Δmeq protegge nei confronti di MDV-IS/R potrebbe essere utile nello sviluppare metodiche di diagnosi e controllo, al momento decisamente necessarie e urgenti.
Tumori indotti dal virus Marek
Diagnosi
Nella diagnosi differenziale dei tumori da MD bisogna valutare diverse malattie, sia neoplastiche che non. Esiste una buona bibliografia che indica come indirizzare la diagnosi negli avicoli. In questo articolo ci concentreremo principalmente con quelle malattie che possono essere confuse con MD e sono riassunte in Figura 1.
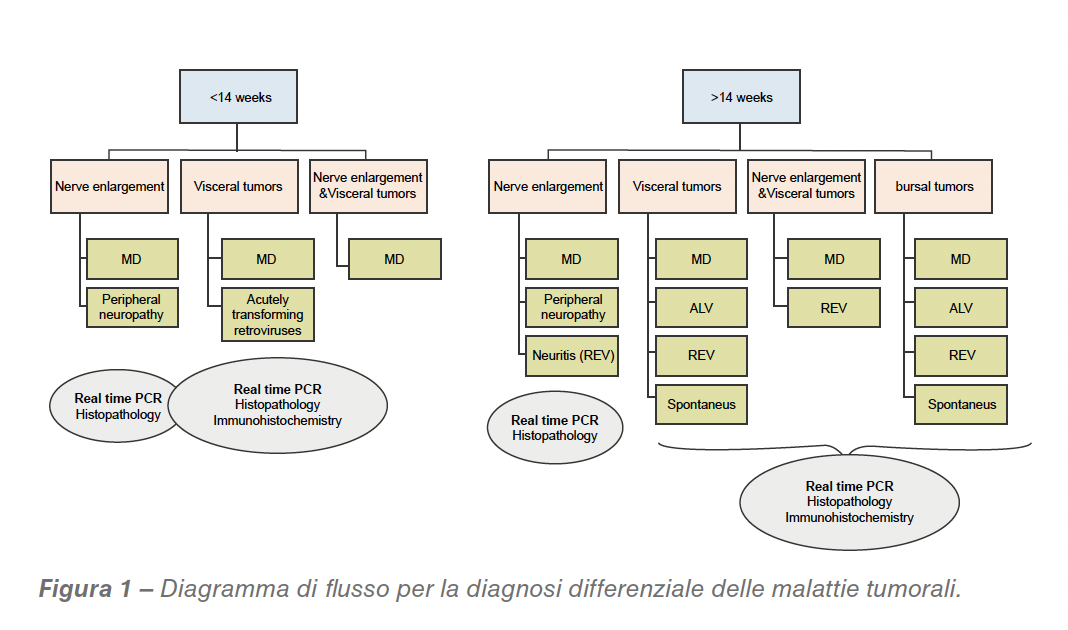
La diagnosi di MD richiede un approccio a stadi multipli. A livello di allevamento, informazioni epidemiologiche (età, stato vaccinale, etc.), sintomi clinici e lesioni, possono suggerire, e a volte confermare, la diagnosi. L’istopatologia è il primo passo per confermare che si tratta di tumori e linfomi; se essa non permette diagnosi, o se non è possibile eseguirla, occorrono altri test, come PCR o immunoistochimica.
Un concetto critico nella diagnosi di MD è che la presenza di MDV oncogenico non significa MD. Poiché infatti i vaccini non proteggono verso l’infezione, la maggior parte (se non tutti) degli avicoli commerciali è esposta a MDV oncogenico in determinati momenti. Diventa quindi critico differenziare tra infezioni latenti e sviluppo dei tumori.
Controllo del focolaio
Investigare le cause di un focolaio di MD è fondamentale per averne il controllo appropriato. Nella Figura 2 è evidenziato un diagramma di flusso con gli step raccomandati. Una volta che la diagnosi di MD è confermata, è importante eseguire un audit in incubatoio, per accertarsi che i vaccini siano somministrati correttamente: essi sono infatti estremamente labili e la maggior parte delle rotture vaccinali deriva proprio da problemi di conservazione, manipolazione o somministrazione degli stessi. È importante ricordare che i vaccini MD sono sospensioni instabili di cellule e che la maggioranza delle cellule in una provetta è non infettata. Perdere anche una piccola percentuale delle cellule potrebbe pertanto significare una riduzione del titolo.
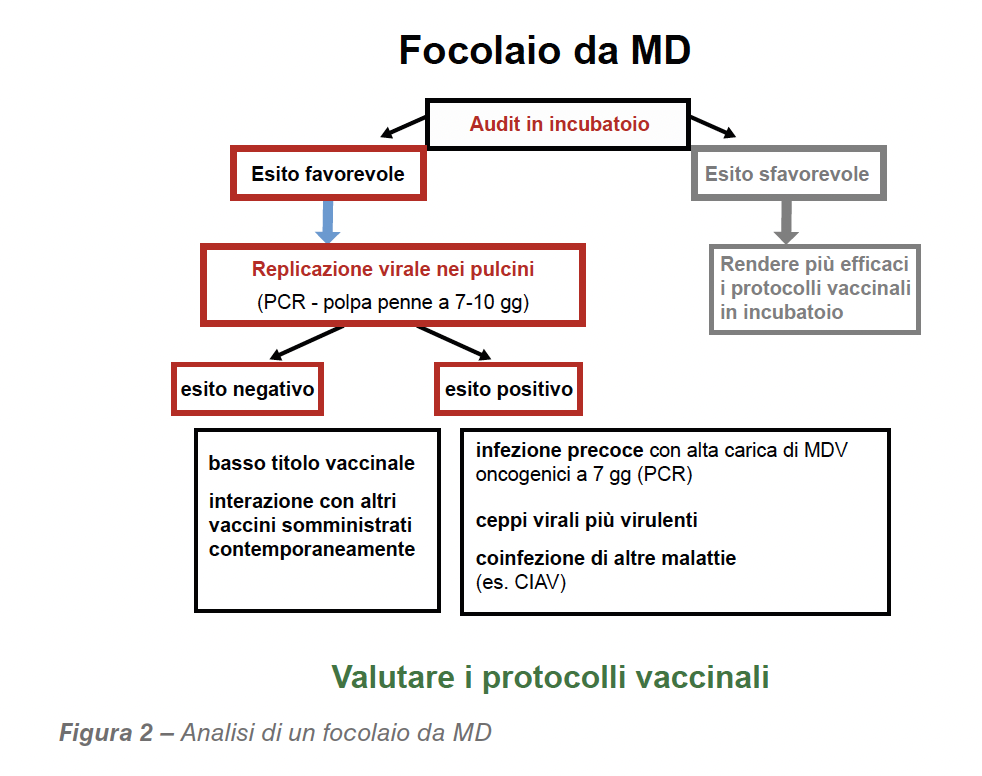
La valutazione della replicazione in vivo del vaccino a 7-10 giorni di vita può confermare se il vaccino sia o meno stato somministrato correttamente. La replicazione vaccinale viene valutata sia nella milza che nella polpa del follicolo delle penne o con qPCR. Una buona percentuale dei polli con livelli rilevabili di vaccino dipende dal protocollo vaccinale utilizzato (vaccino o vaccini usati ed età della vaccinazione), ma non fornirà informazioni circa lo stato vaccinale, anche se potrà fornire una buona stima di come i vaccini sono stati manipolati e somministrati.
Il vaccino MD richiede 5-7 giorni per produrre il livello ottimale di protezione. Si tenga conto che in un allevamento commerciale le infezioni spesso avvengono entro i primi giorni di vita. Per escludere qualsiasi infezione precoce, è possibile controllare la carica del DNA dei virus oncogenici, sia nella milza che nella polpa follicolare delle penne raccolte a 7 giorni. I polli positivi per MDV oncogenico sono una chiara evidenza di infezione precoce e indicano fortemente rotture nei protocolli di biosicurezza come causa primaria.
Monitorare il DNA di MDV oncogenico a tarda età (dai 21 giorni in poi) può essere utile per determinare se il programma vaccinale protegge nei confronti delle infezioni esistenti. È stato dimostrato che, già a 21 giorni, è possibile dividere i polli in 3 categorie (negativi, in latenza o con tumori) sulla base del DNA di MDV oncogenico presente sia nella polpa delle piume che nel sangue. La percentuale di pulcini che ricade nella categoria dei tumori tramite qPCR a 3 settimane è correlata (r=p<0,05) con lo sviluppo di tumori verso le 8 settimane di vita.
Controllo
Il controllo della MD si basa su resistenza genetica, buona biosicurezza, e vaccinazione adeguata. I vaccini sono più efficienti nelle linee di polli resistenti. Inoltre, indipendentemente dalla bontà del vaccino, esso non conferisce protezione all’infezione se questa avviene troppo precocemente; quindi, anche se la vaccinazione è la pietra miliare del controllo della MD, resistenza genetica e biosicurezza non vanno ignorate. Esistono dei validi studi su questi argomenti. Vediamo i tipi di vaccino in uso e come migliorare la protezione che essi inducono.
Tipi di vaccino
Esistono diverse classificazioni di vaccini MD. Possono essere suddivisi in vaccini su cellula (congelati o in azoto liquido) o senza (liofilizzati), oppure, se ci si basa sul sierotipo in MDV-1,MDV-2 e HVT; infine in convenzionali o ricombinanti. In questo articolo usiamo quest’ultima classificazione.
- Vaccini convenzionali. In questa categoria troviamo i ceppi MDV-1 attenuati (CVI988), quelli naturalmente non oncogenici MDV-2 (come SB-1 e 301B) e naturalmente gli HVT non oncogenici. Tutti questi possono essere cellulo-associati ma solo HVT può essere senza cellule, anche se la potezione è inferiore rispetto ad HVT su cellule. La somministrazione di HVT ed MDV2 in contemporanea fornisce una maggior protezione, detta sinergismo protettivo. Tale sinergismo non avviene tra CVI988 e HVT, nonostante la combinazione di questi due ceppi sia pratica comune nell’industria avicola. In genere, i broiler sono vaccinati con HVT, mentre i soggetti a lunga vita (riproduttori e ovaiole) lo sono con MDV-2 e HVT, con CVI988, oppure con HVT e CV1988. L’efficacia dei vaccini MDV dipende notevolmente dall’aplotipo B e quindi la combinazione di vari vaccini potrebbe dare luogo a una migliore protezione del gruppo.
- Vaccini ricombinanti. Lo sviluppo di vaccini ricombinanti MD è partito nei primi anni anni ’90, ma è negli ultimi 15 anni che sono diventati disponibili in commercio e ampiamente usati nell’industria avicola. Tutti i vaccini ricombinanti in uso sono cellulo-associati. Esistono due tipi di vaccini ricombinanti commerciali verso MD: vaccini vettori, che usano HVT come base (rHVT) e vaccini chimera, che sono ceppi di MDV con l’inserzione di una lunga ripetizione terminale (LTR) del virus della reticoloendoteliosi (REV). I pro e contro di questi vaccini sono riassunti in Tabella 2.

Metodiche per migliorare la protezione vaccinale
Si possono usare diverse strategie per migliorare la protezione vaccinale: vaccinazione in ovo, rivaccinazione e uso di adiuvanti. La vaccinazione in ovo ha diversi vantaggi rispetto a quella eseguita a un giorno di vita: si tratta di una pratica completamente automatizzata, che riduce il lavoro e gli errori umani e che consente la somministrazione del vaccino già 3 giorni prima della schiusa, conferendo elevati livelli di protezione nei confronti delle infezioni precoci, aumentando in tal modo lo sviluppo del sistema immunitario.
 Anche la rivaccinazione può aumentare la protezione dei vaccini già precedentemente somministrati prima dell’infezione e il secondo vaccino risulta sempre più efficace del primo. Il protocollo di rivaccinazione ideale include la vaccinazione in ovo con HVT o la combinazione di HVT e altri vaccini MD, seguiti poi da vaccini bivalenti o CVI988. La somministrazione in ovo di HVT comporta una forte attivazione dell’immunità, sia innata che cellulomediata, alla schiusa,così il pulcino sviluppa maggiori risposte immunitarie verso il secondo vaccino.
Anche la rivaccinazione può aumentare la protezione dei vaccini già precedentemente somministrati prima dell’infezione e il secondo vaccino risulta sempre più efficace del primo. Il protocollo di rivaccinazione ideale include la vaccinazione in ovo con HVT o la combinazione di HVT e altri vaccini MD, seguiti poi da vaccini bivalenti o CVI988. La somministrazione in ovo di HVT comporta una forte attivazione dell’immunità, sia innata che cellulomediata, alla schiusa,così il pulcino sviluppa maggiori risposte immunitarie verso il secondo vaccino.
L’uso di adiuvanti nei vaccini MD è stato studiato nel passato e viene ancora usato, ma non è da tutti condiviso. Recentemente, però, lo sviluppo di nuovi adiuvanti suggerisce che quelli a base TLR-3 e TLR-21 potrebbero aumentare la protezione verso MD.
Prospettive future
Poiché nessuno dei vaccini MD conferisce un’immunità sterilizzante, MDV continuerà ad evolvere facilmente. Due sono gli approcci che si potranno adottare per controllare i ceppi emergenti. La situazione ideale per impedire l’evoluzione di MDV è quella di trovare vaccini che blocchino l’infezione nel punto di ingresso o che ne fermino la trasmissione dall’epitelio dei follicoli delle penne. Sviluppare vaccini capaci di indurre un’immunità sterilizzante verso un herpesvirus è però piuttosto difficile, anche se una migliore conoscenza del meccanismo dell’infezione da MDV nei polmoni e nell’epitelio dei follicoli potrebbe tornare utile.
Un secondo approccio prevede il controllo della nuova sindrome associata a ceppi molto virulenti. Gli studi dimostrano che quando MDV diviene più virulento, è anche più immunosoppressivo. Oggi, abbiamo strumenti per la diagnosi e il controllo dei tumori indotti da MDV, ma mancano metodi di diagnosi e controllo di MDV-IS indotto da vv+MDV. Bisogna capire il meccanismo per cui vv+MDV riesce a dare immunosoppressione anche in un pollo ben vaccinato e protetto verso i tumori e valutare come rMd5eq protegga verso MDV-IS/R tardivo. Ciò è fondamentale per stabilire i criteri di diagnosi e le strategie di controllo. Sulla base delle nostre informazioni attuali, bloccare o ridurre la riattivazione di MDV nei linfociti potrebbe essere dunque utile nel controllare non solamente i tumori, ma anche MDV-IS. Le nuove tecnologie per valutare la patogenesi di MDV, come pure lo sviluppo dei vaccini, saranno pertanto la base per il futuro controllo di MDV.
Bibliografia disponibile su richiesta
Dagli atti della XXII WVPA Conference 2023















