Molte specie di funghi producono metaboliti secondari chiamati micotossine, parecchie delle quali sono altamente tossiche per l’uomo e per gli animali. Le micotossine danneggiano le colture e le materie prime, causando perdite economiche.
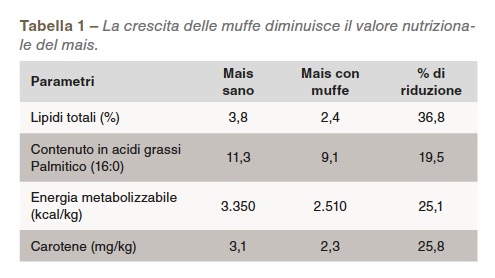
La produzione di tossine avviene per la presenza di muffe su un substrato e in un ambiente idoneo. Se è presente muffa, la produzione di tossine è influenzata dall’umidità, dalla temperatura, dall’ossigeno e dalla natura del substrato. La maggior parte dei mangimi vegetali fornisce un substrato adatto. Le muffe non producono solo micotossine, ma riducono anche il valore nutritivo del mangime (Bartov et al., 1982; Hamilton, 1976), come mostrato nella Tabella 1.
Tipi di micotossine
Esistono più di 400 micotossine note. Le micotossine di maggiore importanza per gli avicoli sono prodotte principalmente da funghi del genere Aspergillus, Fusarium e Penicillium, nella fase di pre-raccolta, durante la raccolta, in deposito o durante la lavorazione del mangime, quando le condizioni sono favorevoli.
Fattori di stress come siccità, scarsa concimazione, alta densità di raccolto, competizione delle erbe infestanti, danno meccanico o presenza di insetti durante la raccolta e le condizioni di conservazione possono influire sulle difese naturali della pianta o dei cereali e contribuire a facilitare l’infezione fungina, portando allo sviluppo di micotossine.
Specie differenti mostrano una diversa suscettibilità alle micotossine. Gli avicoli sono altamente sensibili alle tossine T-2 e moderatamente sensibili alle aflatossine e alle ocratossine; i tacchini sono più sensibili alle aflatossine rispetto ai polli da carne, ma nella maggior parte dei casi più i soggetti sono giovani, più sono predisposti.
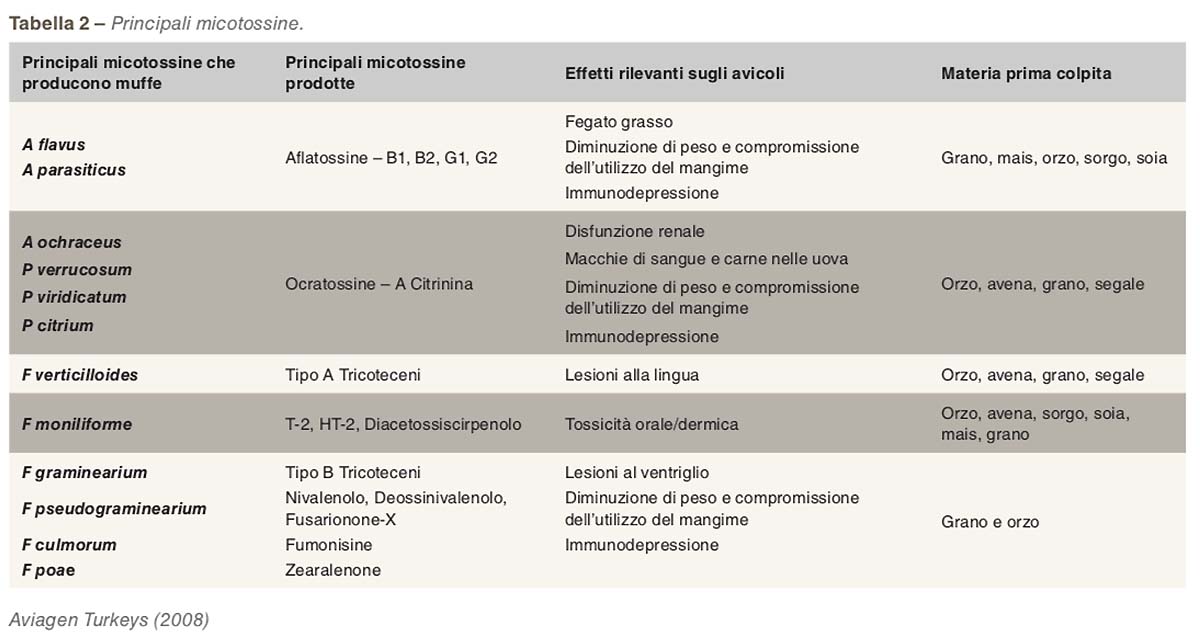
Alcuni ceppi fungini sono in grado di produrre più di una micotossina e una singola micotossina può essere prodotta da più di un tipo di fungo. Le micotossine più rilevanti per gli avicoli e i relativi funghi che le producono sono elencate nella Tabella 2.
Aflatossine
Le aflatossine sono il gruppo più diffuso e più studiato di tutte le micotossine. Questa tossina prolifica in particolar modo in condizioni climatiche caratterizzate da caldo e umido, mentre non è considerata un problema nei climi più freddi; tuttavia, gli scambi globali rendono oggi possibile ovunque il rischio di contaminazione. L’aflatossina B1 è la più comune e biologicamente attiva di tutte le aflatossine e causa una diminuzione della crescita, della produzione di uova e della mortalità. Clinicamente i segni sono anoressia, emorragie viscerali nell’embrione colpito e una maggiore predisposizione allo stress. L’istopatologia dei tacchini rivela fegato grasso, necrosi epatica e iperplasia del dotto biliare. L’aflatossina B1 deprime anche il sistema immunitario e riduce la risposta ai vaccini (Peng et al. 2015, Valchev et al. 2017).
Le aflatossine riducono l’attività di diversi enzimi digestivi, con conseguente riduzione dell’efficienza di conversione. È noto che le aflatossine interferiscono con il metabolismo della vitamina D, contribuendo a ridurre la resistenza ossea e comportando debolezza delle zampe (Hamilton, 1987). La soppressione della sintesi proteica epatica è il principale fattore che determina cali di peso e ridotta produzione di uova. Le aflatossine sono anche associate a scarsa fertilità e schiudibilità.
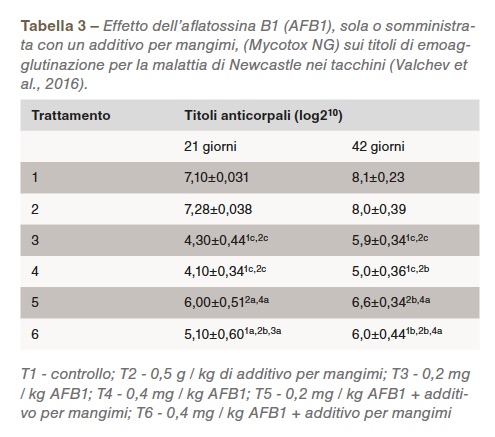
Forse, l’effetto più importante delle aflatossine è la minore risposta immunitaria (CAST, 2003), che rende vano il trattamento con vaccini e medicinali. L’immunodepressione può anche verificarsi a livelli di micotossine non rilevabili con i metodi di screening di routine (Chen et al., 2017. La Tabella 3 mostra l’effetto di due livelli di aflatossina B1 (con e senza legante di tossina) sui titoli di emoagglutinazione della malattia di Newcastle in tacchini giovani.
L’aflatossicosi aumenta la predisposizione alle infezioni da Salmonella (Devegowda e Murthy, 2005). Gli effetti delle aflatossine sulle performance dei soggetti dipendono dalla dose (vedi Tabella 4).

Tricoteceni
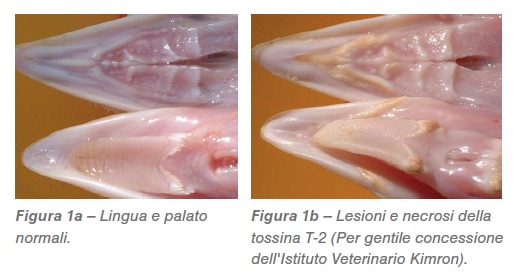
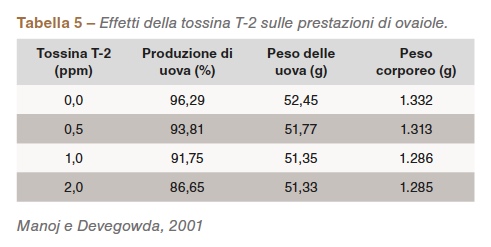
I tricoteceni di tipo A (tossina T-2, tossina HT-2, diacetossiscirpenolo) sono una delle principali preoccupazioni del settore; influenzano la salute e il benessere dei soggetti e causano perdite economiche. Si trovano nei sottoprodotti e nei mangimi a base di cereali e causano dermatite da lesioni orali (Figura 1ab) e irritazione intestinale (Wyatt et al., 1975). Le tossine T-2 riducono il consumo di mangime, sono spesso indicate come “tossine di rifiuto all’alimentazione”, riducono il peso corporeo, la produzione e la qualità delle uova e inducono regressione delle ovaie nelle ovaiole (CAST, 2003). L’effetto della tossina T-2 sulle prestazioni delle ovaiole è stato dimostrato a diversi livelli di dosaggio (Tabella 5).
È noto che le tossine T-2 causano erosioni al ventriglio e necrosi della mucosa proventricolare. Sono le seconde micotossine più immunosoppressive dopo le aflatossine e la presenza contemporanea di entrambe rappresenta la combinazione maggiormente immunodepressiva (Raju e Devegowda, 2002).
Ocratossine
L’ocratossina di tipo A (OTA) è un contaminante comune in molti mangimi. OTA è prodotta principalmente da una specie di Aspergillus. È una nefrotossina che deprime in modo significativo il consumo di mangime, la crescita, il piumaggio, la produzione di uova e l’efficienza di conversione (Hamilton 1982). OTA è teratogena in diverse specie, le anomalie craniofacciali della prole sono i segni più comuni (Malir et al., 2013). Prove aneddotiche suggeriscono che OTA può causare significative perdite e malformazioni embrionali sul campo; influenza anche la qualità del guscio con presenza di macchie gialle e di sangue (Shirley e Tohala, 1983). OTA è tre volte più tossica nei soggetti giovani rispetto alle aflatossine. Gli avicoli gravemente colpiti mostrano depositi di urina nelle articolazioni e nella cavità addominale. La tossicità acuta di OTA determina un’insufficienza renale grave che porta alla morte.
Zearalenone (ZEA) e Deossinivalenolo (DON)
Lo zearalenone è responsabile dei disturbi riproduttivi a causa del suo effetto estrogenico ad alte concentrazioni. I polli sono abbastanza resistenti allo zearalenone; tuttavia, a concentrazioni elevate, si rileva un ingrossamento dell’ano e caratteristiche sessuali secondarie potenziate. Le ovaiole sono resistenti allo zearalenone anche se alimentate fino a 800 mg/kg (Allen et al., 1981), tuttavia lo zearalenone contamina le uova, il che rappresenta un danno in termini di prestazioni riproduttive. I pulcini nutriti con mangimi contaminati contengono ZEA (Bergsj et al., 1993).
Gli avicoli sono abbastanza resistenti al DON, ma nelle ovaiole e nei riproduttori si associa a un ridotto consumo di mangime e la tossina è spesso considerata indice della presenza di altri Fusarium.
Fumonisine
Le fumonisine si trovano soprattutto in climi tropicali e temperati. Gli effetti sulle prestazioni comportano crescita e indice di conversione ridotti. I segni clinici si concretizzano in una mortalità fulminante che comprende paralisi, gambe e collo stesi, scarsa deambulazione, soggetti che ansimano, aumento del peso del fegato e necrosi epatica.
Contaminazione combinata di micotossine
La copresenza di micotossine sembra esercitare un impatto negativo amplificato sulla salute e sulla produttività rispetto alle singole tossine; per esempio sia l’aflatossina che l’ocratossina sono estremamente tossiche e agiscono sinergicamente. La tossicità che risulta dalla doppia esposizione all’aflatossina e all’ocratossina è molto maggiore della somma delle loro singole tossicità. Nelle ovaiole, gli effetti di T-2 e diacetossiscirpenolo (DAS) si amplificano per quanto riguarda l’assunzione di mangime, le lesioni orali, lievi variazioni nelle attività degli enzimi plasmatici e riduzione della produzione di uova (Diaz et al., 1994).
I funghi non si trovano nei mangimi come colture pure, quindi il numero di possibili combinazioni di tossine è molto significativo. I co-contaminanti scientificamente stabiliti sono elencati nella Tabella 6.
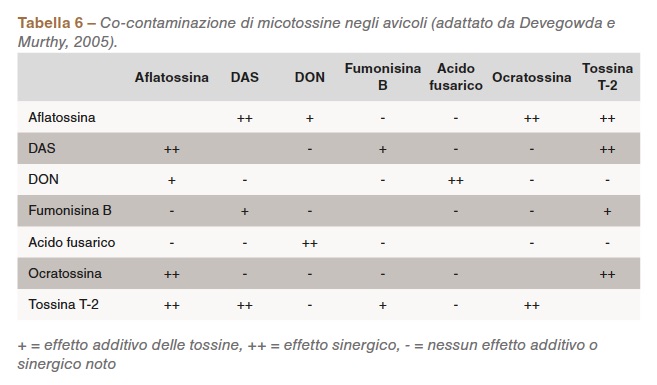
Un elemento rilevante consiste nel fatto che un test positivo per una particolare tossina nel mangime è indicativo di condizioni di crescita favorevoli non solo per quei funghi in particolare, ma anche per gli altri. Pertanto è importante testare il mangime anche per altri co-contaminanti.
Test per le micotossine
È fondalmentale predisporre un rigoroso programma di test per valutare il rischio di micotossine nei mangimi e per identificare i lotti contaminati. Vi sono differenze significative nel processo di analisi causate dalla variabilità nel campionamento, nella preparazione del campione e nella variazione analitica.
La Tabella 7 mostra la variabilità associata alla misurazione dell’aflatossina in un sacco di mais contaminato; la variazione nel campionamento contribuisce per oltre il 75% all’errore complessivo del test (Whitaker et al., 2005).
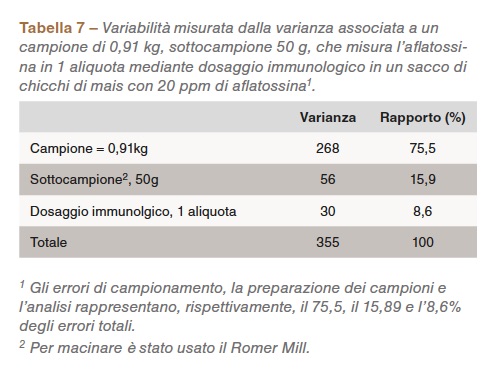
L’errore di campionamento è ampio a causa della cospicua distribuzione tra particelle contaminate all’interno di un lotto; si stima che solo 6 semi su 10.000 siano contaminati in un lotto contenente una concentrazione di aflatossina di 20 ppb (Johansson et al., 2000b). Un singolo punto campione o un punto di sondaggio è soddisfacente se le particelle contaminate sono equamente distribuite nel lotto; tuttavia, le micotossine si presentano generalmente in sacche isolate nel lotto (Shotwell et al., 1975). Si può aumentare la possibilità di identificare i lotti contaminati prelevando un maggior numero di campioni da un lotto. Le procedure utilizzate per prelevare un campione da un lotto sono estremamente importanti, ogni singolo elemento del lotto dovrebbe avere uguali possibilità di essere scelto.
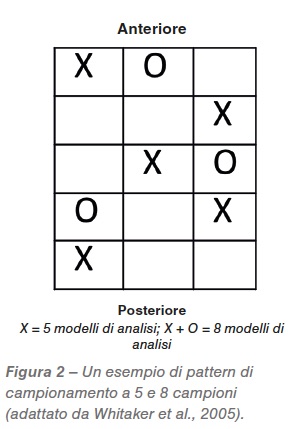
Il campione dovrebbe essere un insieme di varie piccole porzioni prelevate in molti punti diversi di tutto il lotto (Bauwin e Ryan, 1982; Hurburgh e Bern, 1983). Quando si estrae un campione da un contenitore di grandi dimensioni è necessario sviluppare un modello di ispezione, tale che il prodotto possa essere raccolto in diverse posizioni nel lotto. Nella Figura 2 è riportato un esempio di schema di sondaggio utilizzato dall’USDA.
La sonda di campionamento dovrebbe essere abbastanza lunga da raggiungere il fondo del contenitore, se possibile. Quando si campiona da un flusso in movimento, per esempio un nastro trasportatore, è necessario effettuare piccoli incrementi lungo l’intera lunghezza del flusso per ottenere un campione globale; se il campione totale è più ampio del necessario, bisogna miscelarlo e suddividerlo per avere la quantità di prova della dimensione desiderata.
Analisi
Prove a strisce rapide: l’analisi per la presenza di micotossine sui mangimi può essere condotta in modo efficiente attraverso l’uso di kit di analisi di immunoassorbimento enzimatico (ELISA) e diventare uno strumento standard per il monitoraggio rapido delle micotossine (Molinelli et al., 2009b). Questo metodo è soddisfacente per stabilire se uno specifico mangime sia sotto o sopra il livello di conformità legale. Le analisi HPLC e GC-MS forniscono una determinazione più accurata del livello e del tipo di micotossine presenti nel mangime.
Alcune tossine possono sfuggire al rilevamento in quanto possono essere mascherate da glicosidi o proteine attaccate alla tossina, fornendo un risultato falso negativo e, in tal caso, sono necessari metodi di analisi più raffinati per misurarle. I biotest sono utilizzati per stabilire la presenza di micotossine specifiche; un esempio è l’uso di crostacei come l’artemia salina (Figura 3), valutando poi il tasso di sopravvivenza su un campione di materiale (Hardwig e Scott, 1971; Meyer et al., 1982).
La valutazione dei livelli di muffa nei cereali può indicare il possibile sviluppo di micotossine. Testare il materiale per livello e tipo di muffa può, talvolta, indicare la probabilità di contaminazione. Capita tuttavia che le muffe non siano più presenti nel materiale, ma permangano le micotossine; quindi, la migliore pratica è analizzare sia per le muffe che per le micotossine. Danni o stress alla pianta arrecati da malattie, insetti, volatili, erbe infestanti, gelo o siccità, consentono un facile ingresso di muffe e funghi e favoriscono lo sviluppo di muffe. Il grano danneggiato dagli insetti è più vulnerabile alle muffe, quindi ridurre le infestazioni è fondamentale per prevenirne la crescita nei cereali. Alcune tossine, come le aflatossine, tendono a verificarsi in chicchi rotti e danneggiati e in materiale estraneo. Bisogna evitare di raccogliere i cereali se il livello di umidità è alto e conservarli in contenitori con ventilazione forzata, in locali isolati e ben ventilati, monitorandone la temperatura. L’essiccazione del grano lenta e a basse temperature per lunghi periodi favorisce lo sviluppo di aflatossine. Tutte le attrezzature e gli impianti di stoccaggio devono essere mantenuti ben ventilati, puliti e asciutti, prima e durante l’uso. Gli impianti di stoccaggio devono essere ben isolati dall’umidità e tutti i residui rimossi per ridurre la contaminazione.
L’uso di inibitori di muffe in forma liquida o secca e di acidi organici, come l’acido propionico e l’isobutirrato di ammonio, prevengono la crescita delle muffe se applicati correttamente al momento dell’ingresso nel silos. Tuttavia, gli acidi organici non distruggono le tossine già presenti nel grano (Hammond e Sumner, 2009).
Valutazione visiva del lotto
Cercate indizi visivi di contaminanti: i cereali possono mostrare segni di crescita di muffe (Figura 4) e/o danni da insetti e presenza di elementi associati alla crescita di muffe.

Pulizia
Durante il processo di pulizia della polvere di grano contaminata, le bucce, la peluria e le particelle superficiali vengono spazzate via con l’aspirazione o la pulizia. È dimostrato che i detergenti per cereali riducono il livello di aflatossina nel mais fino al 50%.
Selezione meccanica e separazione
In questo processo il prodotto pulito viene separato dai grani contaminati da micotossine. Sono possibili perdite elevate di mangime a causa di una separazione incompleta e non accurata. Pertanto, lo smistamento meccanico e la separazione non sono sempre considerati efficienti in termini di costi. In alcuni Paesi non è ammesso materiale “miscelato” e analizzato a livelli superiori a quelli consentiti per le tossine.
Lavaggio
Le procedure di lavaggio che utilizzano acqua o soluzione di carbonato di sodio riducono le micotossine nei cereali.
Trattamento:
Approcci nutrizionali
- Livelli alti di antiossidanti, metionina, selenio e vitamine nei mangimi colpiti contrastano gli effetti delle micotossine, così come l’aggiunta di clorofilla, i derivati delle alghe e l’aspartame.
Eliminazione chimica delle tossine
– L’eliminazione chimica con composti ammoniacali è considerata uno dei mezzi più pratici per la decontaminazione dell’aflatossina nei prodotti agricoli (Leeson et al., 1995). L’inattivazione dell’aflatossina con ammonizzazione nelle ovaiole da riproduzione non ha comportato effetti dannosi sulla risposta immunologica data dalla vaccinazione per malattia di Newcastle, come misurato dai titoli di inibizione dell’emoagglutinazione (Boulton et al., 1982). Il perossido di idrogeno è un agente ossidante accettabile negli alimenti e ha il potenziale di distruggere le aflatossine fino al 97%. Effetti simili sono stati rilevati con il trattamento con acidi organici e tensioattivi (Bothast et al., 1976; Rodriguez e Mahoney, 1994).
Agenti sequestranti delle micotossine
L’integrazione al mangime di agenti sequestranti, antinutrizionali, è di gran lunga il metodo più pratico e più ampiamente studiato per ridurre gli effetti dell’esposizione alle micotossine (Diaz e Smith, 2005).
– Il carbone attivo è una forma amorfa di carbonio riscaldato in assenza di aria e trattato con ossigeno per aumentarne la porosità. Alcuni dati indicano che il carbone attivo è efficace nell’assorbire alcune aflatossine, ma non le tossine derivate da altre specie. Il carbone attivo può anche comportare l’assorbimento di micronutrienti nel mangime.
– I minerali di silicato (argille) comprendono bentonite, zeolite e silicato idrato di alluminio, di sodio e calcio. La tecnica di assorbimento utilizza composti che formano un complesso, con la tossina che impedisce l’assorbimento dell’aflatossina nell’epitelio intestinale e riduce la quantità di tossina assorbita nel flusso sanguigno. Livelli elevati di inclusione potrebbero fornire una capacità di sequestro eccessiva, che potrebbe ridurre la biodisponibilità di importanti micronutrienti (Diaz e Smith, 2005). Le argille tendono a ridurre l’utilizzo di minerali: manganese, zinco e magnesio, cloruro di rame e sodio (Devegowda e Murthy, 2005).
- L’azione adsorbente delle pareti cellulari di lievito, principalmente glucomannano modificato, è in grado di assorbire livelli elevati di varie micotossine a tassi di inclusione inferiori rispetto ai leganti inorganici (Mahesh e Devegouda, 1996). La specifica modalità di azione di alcuni componenti della parete cellulare del lievito suggerisce che la loro attività non influisca sulla disponibilità di micronutrienti. È stato dimostrato che il glucomannano modificato lega la tossina derivata da fusarium.
Biotrasformazione
La disintossicazione biologica da parte di enzimi e/o microrganismi degrada le micotossine nel tratto gastrointestinale, prima che si verifichi l’assorbimento nell’animale. Esistono prodotti a base di enzimi e microrganismi efficaci nella trasformazione di tossine specifiche, come le fumonisine e i tricoteceni in metaboliti non tossici.
Riassumendo, ecco i punti cruciali da tenere bene in considerazione
- Prevenire la crescita di muffe sulle colture, durante la raccolta, lo stoccaggio e la lavorazione dei mangimi.
- Implementare i mezzi meccanici per rimuovere il materiale contaminato dal mangime e considerare l’aggiunta di inibitori/killer di muffa.
- Implementare un programma di test per micotossine. Ciò è importante non solo dal punto di vista della valutazione del rischio a livello di allevamento, ma anche da quello normativo e della salute umana.
- Applicare un piano di campionamento efficace. Aumentare la quantità e la dimensione dei campioni prelevati da un lotto può ottimizzare l’efficacia dei test e le possibilità di identificare i lotti contaminati.
- Rilevare e quantificare la concentrazione di muffe e micotossine nel mangime, tenendo presente che sono molte le micotossine che, in concomitanza, possono contaminare le materie prime, e che il rilevamento di una tossina può indicare la presenza di un’altra micotossina più tossica.
- Quando il mangime è contaminato, agire prima che i soggetti lo consumino, non dopo che sono stati intossicati.
- Rimuovere e sostituire il mangime o applicare un legante per micotossine oppure un agente biotrasformante specifico per il tipo di tossina rilevata nel mangime.
- Monitorare i soggetti in ogni prestazione o per rilevare segni clinici di micotossicosi.
- Implementare un programma di sorveglianza delle micotossine aggiornato.
La bibliografia è disponibile su richiesta